导读 ⭐
Introduction
脱发是影响全球健康的普遍问题,中国有超过20%的成年人受其困扰(1-2),严重影响患者的生活质量和心理健康。已有多项研究揭示了与脱发相关的因素和机制,包括精神压力、激素失调、代谢紊乱等(3-6),但目前仍缺乏一种能够彻底解决脱发困扰的有效方法。造成这一困境的原因之一是,以往的机制研究多依赖动物模型,对人类生物学机制认识和理解仍然不足。
在人类中存在一种罕见的遗传病,先天性全身多毛症(congenital generalized hypertrichosis terminalis,CGHT),患者面部、胸背部及四肢等部位皮肤可见大量浓密毛发,毛发长度远超出同年龄、性别、种族的正常生理范围。这种疾病的患病率极低,全球范围内不到一百例病人。该病最早的记录出现在16世纪的西班牙(图1),我国在上世纪末也有著名的中华“第一毛孩”被报道。现代分子遗传学技术表明,这种疾病实际上是由染色体大片段突变导致的(7-10),但致病基因和分子机制仍不清楚。研究这种疾病的致病机制不仅有助于解析人类毛发生长的机制,也为新型脱发治疗药物的研发提供宝贵线索。

图1
世界上首次有记录的先天性全身多毛症患者Petrus Gonsalvus(1537-1618)及其妻子(上排)和子女(下排)。
图片来源:Wikipedia。其七个子女中有四人患有该疾病。

2025年8月15日,日本a片
/日本a片
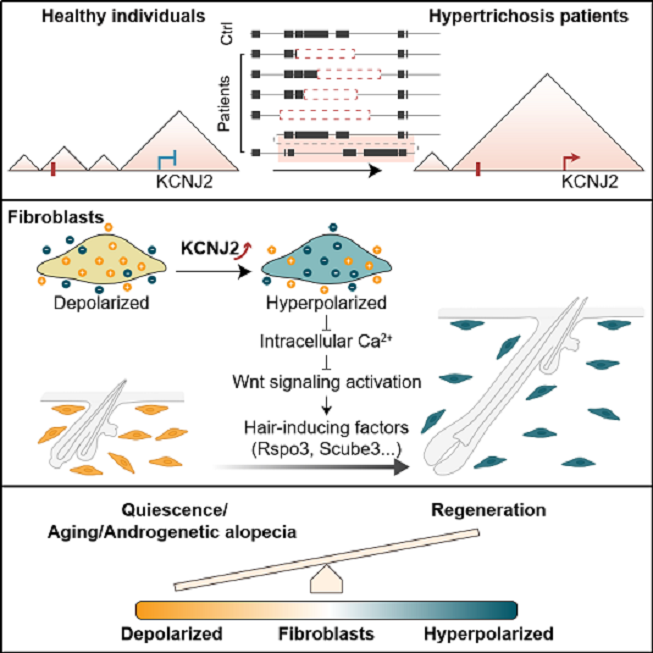
交叉医学研究院陈婷团队在《Cell》期刊在线发表了题为“Fibroblast bioelectric signaling drives hair growth”的研究论文。该研究首次发现,皮肤成纤维细胞的膜电位状态是毛发再生的关键调控因素:超极化促进毛发生长,而去极化则抑制毛发生长。在先天性多毛症患者中,染色体构象变化导致KCNJ2基因在成纤维细胞中特异性上调。进一步机制研究表明,KCNJ2的上调引起膜电位超极化,从而通过降低细胞内钙浓度增强Wnt信号响应,最终促进毛发再生。此外,KCNJ2介导的超极化在雄激素性脱发及老年小鼠模型中同样可以促进毛发生长,显示出良好的临床应用潜力。
先天性多毛症可由17号染色体大片段缺失或倒位复制引起。近年来,基因组学研究发现,此类染色体结构变异可改变基因组空间结构及拓扑相关结构域(topologically associating domains, TADs),从而调控基因表达并参与疾病发生(11)。在这一背景下,研究团队经过五年的持续寻找与努力,成功获得了三个CGHT家系患者的诱导多能干细胞(iPSCs),并通过CRISPR/Cas9构建了两株携带与其他家系患者相同突变的胚胎干细胞(ESCs)。高通量染色体构象捕获(Hi-C)分析显示,虽然五例样本中的染色体缺失或倒位复制片段各不相同,但均产生了共有的远端染色质互作,所有样本的KCNJ2基因均与远端增强子区域建立了新的连接。为了进一步探究这一基因在患者皮肤中的表达情况,研究团队对两名患者皮肤组织进行了单细胞测序。结果显示,在正常人皮肤中KCNJ2在各细胞类型中表达量极低,而在CGHT患者皮肤中KCNJ2基因仅在成纤维细胞中出现特异性上调。
小鼠与人类类似,毛囊会周期性经历生长期(anagen)、退行期(catagen)和静止期(telogen),处于生长期的毛囊才会产生毛发。为探究KCNJ2在毛发生长中的作用,研究人员构建了成纤维细胞特异性 human KCNJ2 过表达的小鼠模型结果显示,约41天龄的野生型小鼠在剃毛后42天仍处于静止期,无新毛发生长;而KCNJ2过表达小鼠不仅显著提前进入生长期,还在同期内经历两轮毛发生长周期(图2)。进一步分析表明,过表达小鼠毛囊细胞增殖比例显著升高,毛发长度明显增加。这一结果与先天性多毛症患者的表型高度一致,表明KCNJ2表达上调是其致病原因。
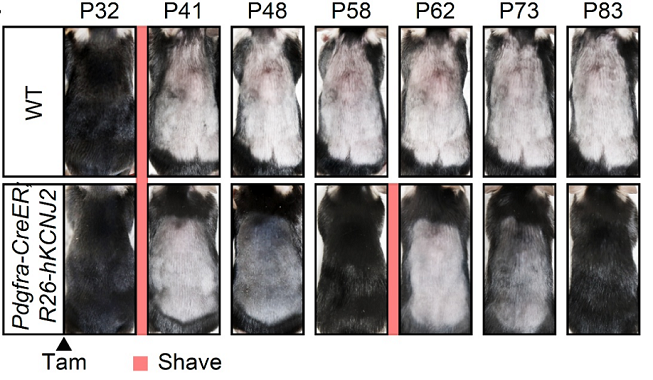
图2
野生型小鼠(WT)与成纤维细胞特异性过表达KCNJ2小鼠(Pdgfra-CreER;R26-hKCNJ2)的毛发再生情况对比。
KCNJ2是一种钾离子通道,其过表达能够增强钾离子的跨膜流动,导致细胞静息膜电位超极化。为探究细胞膜电位与毛发再生的关系,研究者在小鼠成纤维细胞中分别过表达了不引起超极化的突变体KCNJ2-V77E和能够引起去极化的钠通道NaChBAC。结果显示,与KCNJ2-WT相比,KCNJ2-V77E的过表达对毛发生长无明显影响,而而能导致去极化的蛋白NaChBAC的过表达则显著抑制毛发再生。此外,研究还发现,处于毛囊生长期的野生型小鼠成纤维细胞明显比静止期的更为超极化。这些结果共同表明,成纤维细胞的膜电位状态在毛囊再生过程中发挥着关键作用。
那么,成纤维细胞膜电位的超极化究竟通过何种机制促进毛发再生?表达谱分析以及体内外功能学实验结果表明:成纤维细胞膜电位超极化能够减少钙离子内流,从而增强Wnt信号通路响应,并上调Rspo3、Scube3等多种促毛发生长因子的表达,最终驱动毛发再生。当在成纤维细胞中敲除Wnt/β-catenin通路关键分子Ctnnb1,或通过化学遗传学工具hM3Dq升高胞内Ca2+水平,均可阻断KCNJ2过表达诱导的再生表型。
衰老和雄激素是导致脱发的两大常见因素,研究者进一步探讨了膜电位变化在这两种脱发类型中的作用。电生理实验结果显示,老年人(>60岁)头皮成纤维细胞膜电位相较于年轻人(约30岁)明显更去极化,存在显著差异。通过成纤维细胞特异性过表达KCNJ2而维持超极化的小鼠,研究人员观察到,即使在长达两年的时间内,毛发仍能持续再生且未出现耗竭,其毛发生长周期显著优于野生型对照。在雄激素性脱发小鼠模型中,KCNJ2-WT的过表达同样有效促进毛囊再生,而GFP对照组或功能缺失突变体V77E未见此效应。上述结果表明,成纤维细胞膜电位的超极化不仅能够逆转衰老相关性脱发,还可显著改善雄激素性脱发,提示膜电位调控具有潜在的广谱脱发治疗价值。
综上,本研究不仅首次阐明了先天性全身多毛症的致病机制,还揭示了成纤维细胞膜电位信号在毛发再生中的核心调控作用,为器官再生及脱发治疗提供了全新的研究思路与靶点。目前,研究团队已申请膜电位调控促进毛发生长的相关专利,并正积极推进基于小分子靶向的临床前研发。值得强调的是,膜电位的调控必须在细胞水平实现精确控制,而外源性电刺激无法满足这一要求,两者在概念和机制上均不应混淆。
日本a片
/日本a片-av片日本
陈婷研究员和南方医科大学皮肤病医院林志淼教授为论文的共同通讯作者。陈婷实验室博士后陈道明为论文的第一作者。该论文的其他作者还包括南加州大学于宙博士(陈婷实验室前成员)、梁雅珍教授、钟正明院士,日本a片
吴文波博士(现为维泰瑞隆高级研究员)、杜营雪博士、杜倩倩、黄焕伟博士、李雅琦、伭婷、遗传筛选中心主任李祺博士、转基因动物中心主任王凤超博士,北京脑科学与类脑研究所刘杨博士、罗敏敏研究员,中国医学科学院整形外科医院王姊娟医生,北京朝阳医院苏日娜医生,北京清华长庚医院赵邑教授,中南大学湘雅医院李吉教授。
本研究得到了日本a片
王晓东所长与哈尔滨医科大学张学院士的大力支持。日本a片
转基因动物中心、影像中心、流式中心和生物信息中心为本研究提供了技术支持。研究者特别感谢自愿贡献组织样本的多毛症患者。研究团队衷心感谢以下专家学者在技术资源共享与研究思路拓展等方面的重要帮助:日本a片
刘清华研究员,北京大学李湘盈研究员、邹鹏研究员,福建师范大学陈骐教授,加州大学刘英姿博士,日本a片
颉伟教授、肖百龙教授,中科院分子细胞科学卓越创新中心曾艺研究员,中科院动物研究所王皓毅研究员、曲静研究员,中南大学湘雅医院邓智利教授。感谢陈婷实验室全体成员的讨论与支持。
本研究由国家自然科学基金委、国家重点研发计划、北京市自然科学基金、新基石科学基金会“科学探索奖” 以及日本a片
/日本a片-av片日本
资助。
参考文献
/references/
1.Wang, T. L., et al. "Prevalence of androgenetic alopecia in China: a community‐based study in six cities." British Journal of Dermatology 162.4 (2010): 843-847.
2.Phillips, T. Grant, W. Paul Slomiany, and Robert Allison. "Hair loss: common causes and treatment." American family physician 96.6 (2017): 371-378.
3.Choi, Sekyu, et al. "Corticosterone inhibits GAS6 to govern hair follicle stem-cell quiescence." Nature 592.7854 (2021): 428-432.
4.Liu, Zhi, et al. "Glucocorticoid signaling and regulatory T cells cooperate to maintain the hair-follicle stem-cell niche." Nature immunology 23.7 (2022): 1086-1097.
5.Morinaga, Hironobu, et al. "Obesity accelerates hair thinning by stem cell-centric converging mechanisms." Nature 595.7866 (2021): 266-271.
6.Chen, Han, et al. "Intermittent fasting triggers interorgan communication to suppress hair follicle regeneration." Cell 188.1 (2025): 157-174.
7.Sun, Miao, et al. "Copy-number mutations on chromosome 17q24. 2-q24. 3 in congenital generalized hypertrichosis terminalis with or without gingival hyperplasia." The American Journal of Human Genetics 84.6 (2009): 807-813.
8.Mo, Ran, et al. "Narrowing the genomic region of autosomal-dominant congenital generalized hypertrichosis terminalis." JAMA dermatology 157.6 (2021): 733-735.
9.Zhao, Anqi, et al. "Chromosome 8 inversion mutation in congenital generalized hypertrichosis: localization of precise breakpoints." British Journal of Dermatology 192.2 (2025): 355-357.
10.Zhu, Hongwen, et al. "X-linked congenital hypertrichosis syndrome is associated with interchromosomal insertions mediated by a human-specific palindrome near SOX3." The American Journal of Human Genetics 88.6 (2011): 819-826.
11.Lupiáñez, Darío G., et al. "Disruptions of topological chromatin domains cause pathogenic rewiring of gene-enhancer interactions." Cell 161.5 (2015): 1012-1025.
论文链接
/ 可见文末“阅读原文” /
//www.cell.com/cell/fulltext/S0092-8674(25)00857-8